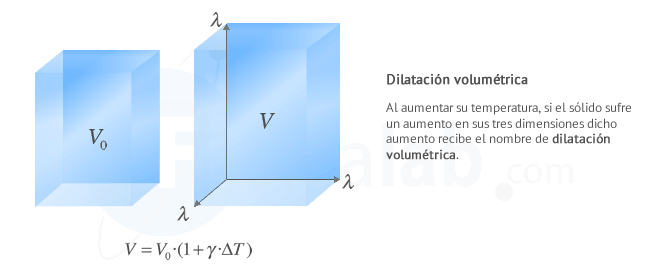
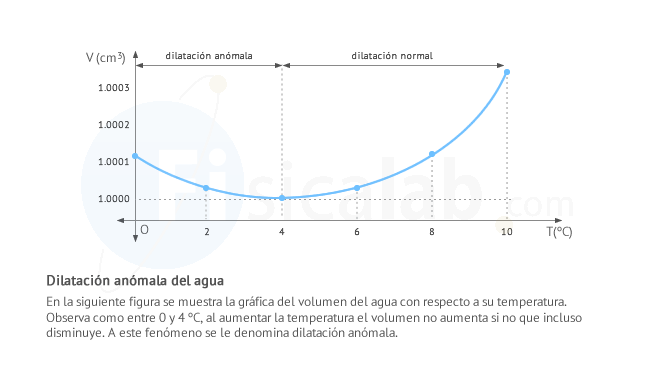
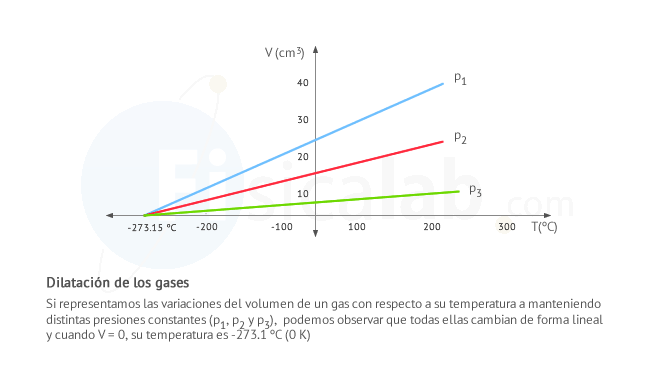
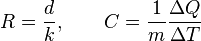Transferencia de calor
La transferencia de calor es el paso de energía térmica desde un cuerpo de mayor temperatura a otro de menor temperatura. Cuando un cuerpo, por ejemplo, un objeto sólido o un fluido, está a una temperatura diferente de la de su entorno u otro cuerpo, la transferencia de energía térmica, también conocida como transferencia de calor o intercambio de calor, ocurre de tal manera que el cuerpo y su entorno alcancen equilibrio térmico. La transferencia de calor siempre ocurre desde un cuerpo más caliente a uno más frío, como resultado del segundo principio de la termodinámica. Cuando existe una diferencia de temperatura entre dos objetos en proximidad uno del otro, la transferencia de calor no puede ser detenida; solo puede hacerse más lenta.
Índice
[ocultar]Modos de transferencia[editar]
Los modos de transferencia son diferentes procesos de transporte de calor, usualmente se agrupan en tres tipos según haya también transferencia o no transferencia de materia (o fotones)como los siguientes :
- Conducción: Es la transferencia de calor que se produce a través de un medio estacionario -que puede ser un sólido- cuando existe una diferencia de temperatura.
- Convección: Se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas. La convección se produce únicamente por medio de materiales fluidos. Lo que se llama convección en sí, es el transporte de calor por medio del movimiento del fluido, por ejemplo: al trasegar el fluido por medio de bombas o al calentar agua en una cacerola, la que está en contacto con la parte de abajo de la cacerola se mueve hacia arriba, mientras que el agua que está en la superficie, desciende, ocupando el lugar que dejó la cacerola caliente.
- Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.1
Aislamiento y barreras de radiación[editar]
Los aislantes térmicos son materiales específicamente diseñados para reducir el flujo de calor limitando la conducción, convección o ambos. Las barreras de radiación, son materiales que reflejan la radiación, reduciendo así el flujo de calor de fuentes de radiación térmica. Los buenos aislantes no son necesariamente buenas barreras de radiación, y viceversa. Los metales, por ejemplo, son excelentes reflectores pero muy malos aislantes.
La efectividad de un aislante está indicado por su resistencia (R). La resistencia de un material es el inverso del coeficiente de conductividad térmica (k) multiplicado por el grosor (d) del aislante. Las unidades para la resistencia son en el sistema internacional de unidades: (K·m²/W).
La fibra de vidrio rígida, un material aislante usado comúnmente, tiene un valor R de 4 por pulgada, mientras que el cemento, un mal conductor, tiene un valor de 0.08 por pulgada.2
La efectividad de una barrera de radiación está indicado por su reflectividad, la cual es una fracción de la radiación reflejada. Un material con una alta reflectividad (en unalongitud de onda) tiene una baja absortividad, y por consiguiente una baja emisividad. Un reflector ideal tiene un coeficiente de reflectividad igual a 1, lo que significa que refleja el 100% de la radiación entrante. Por otro lado, en el caso de un cuerpo negro, el cual tiene una excelente absortividad y emitividad de la radiación térmica, su coeficiente de reflectividad es casi 0. Las barreras de radiación tiene una gran aplicación en ingeniería aeroespacial; la gran mayoría de los satélites usan varias capas aislantes aluminizadas que reflejan la luz solar, lo que permite reducir la transferencia de calor y controlar la temperatura del satélite.
Disciplinas académicas[editar]
Los fenómenos de transferencia son generalmente parte del programa de estudios de ingeniería aeroespacial, ingeniería electromecánica, ingeniería industrial, ingeniería química, ingeniería agrícola o ingeniería mecánica. Comúnmente, los conocimientos sobre termodinámica son una condición previa para el estudio de la transmisión de calor, dado que las leyes de la termodinámica son esenciales para comprender el mecanismo de la transferencia de calor. Otras disciplinas relacionadas con la transmisión de calor incluyen la conversión de energía, termofluidos y transferencia de materia.

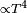 y la convección
y la convección 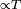 .
.